缺血性心脏病是全球范围内致残和致死的主要原因之一,其核心病理改变为心肌细胞不可逆丢失伴随电传导系统异常,常引发心律失常和心力衰竭。在心肌组织工程中,一项重要挑战在于如何在体外构建具备仿生功能的工程化心肌组织(ECT),以支持心脏修复并实现与宿主心肌的电同步整合。近年来,通过导电支架或外源电刺激构建仿生电学微环境,已成为促进ECT结构及功能成熟的有效策略,但其分子机制仍不明确——尤其是外源电信号如何被细胞感知与转导,并最终调控基因表达、蛋白质组装及细胞功能等关键过程。因此,系统阐明电学微环境促进ECT中细胞成熟的分子机制,对推动其临床转化具有关键科学意义。

近期,西安交通大学生命学院张晓慧教授团队首次系统阐明了体外电学微环境在促进ECT功能成熟中的作用机制,提出外源电信号可通过S100A11/ANXA2复合体有效转导进入细胞,并通过调控电诱导的钙内流、瞬时膜电位(IMP)及钙诱导钙释放(CICR)发挥关键作用,从而促进肌节排列和细胞骨架成熟;同时,S100A11通过核转位激活转录因子表达,强化细胞的兴奋–收缩耦联(E−C coupling),显著增强ECT细胞的同步搏动能力。相关内容以“S100A11/ANXA2轴介导电转导以促进工程化心肌组织中的电诱导收缩”(S100A11/ANXA2 Axis Mediates Electrotransduction to Promote Electrically−induced Contraction in Engineered Myocardial Tissues)为题,在国际权威期刊《生物材料》(Biomaterials)上发表。
研究团队通过构建三种体外电学微环境模型,系统探讨了其对ECT中心肌细胞功能的调控机制。三种模型分别为:非导电丝素支架(Silk,模拟非导电环境)、导电还原氧化石墨烯/丝素复合支架(rGO/Silk,模拟在体导电环境),以及在rGO/Silk基础上施加节律性电刺激(rGO/Silk+ES,模拟窦房结节律性动态电学微环境)。研究结果表明,导电微环境(尤其联合电刺激)可显著上调F-actin、α-actinin及Cx43的表达,并促进基因Actn1/4表达,提示电信号促进细胞骨架装配与结构成熟。电生理方面,电学微环境显著增强钙内流、提高IMP的振幅与频率,并强化CICR过程,从而改善了细胞E−C耦联及同步搏动。导电支架与电刺激联合干预表现出协同增强效应,各项指标提升尤为显著(图1)。
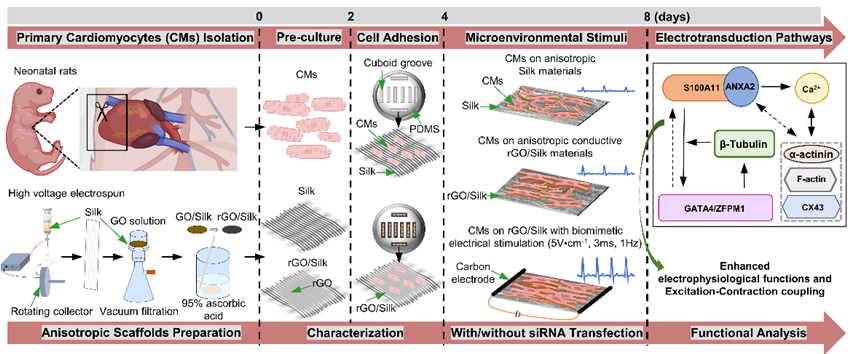
图1.不同电学微环境下,S100A11/ANXA2介导的信号转导通路
(图源:Xue et al., Biomaterials, 2025)
为进一步分析外部电学微环境对ETC细胞的电生理和成熟的调控,团队对NRCMs在Silk、rGO/Silk及rGO/Silk+ES条件下的全基因组转录变化进行了分析。结果显示,rGO/Silk及rGO/Silk+ES显著上调了一类与钙离子结合、膜功能及细胞骨架相关的基因,提示其提示其在电学信号转导中有关键作用。FPKM分析显示其中S100a11表达最高,且被导电材料显著上调,电刺激进一步协同增强其表达。结构建模提示S100A11与ANXA2通过非共价相互作用形成异源四聚体。siRNA沉默实验进一步显示,敲低任一基因均显著削弱细胞对电信号的响应及共定位系数,表明S100A11与ANXA2互作且形成稳定复合体(图2)。
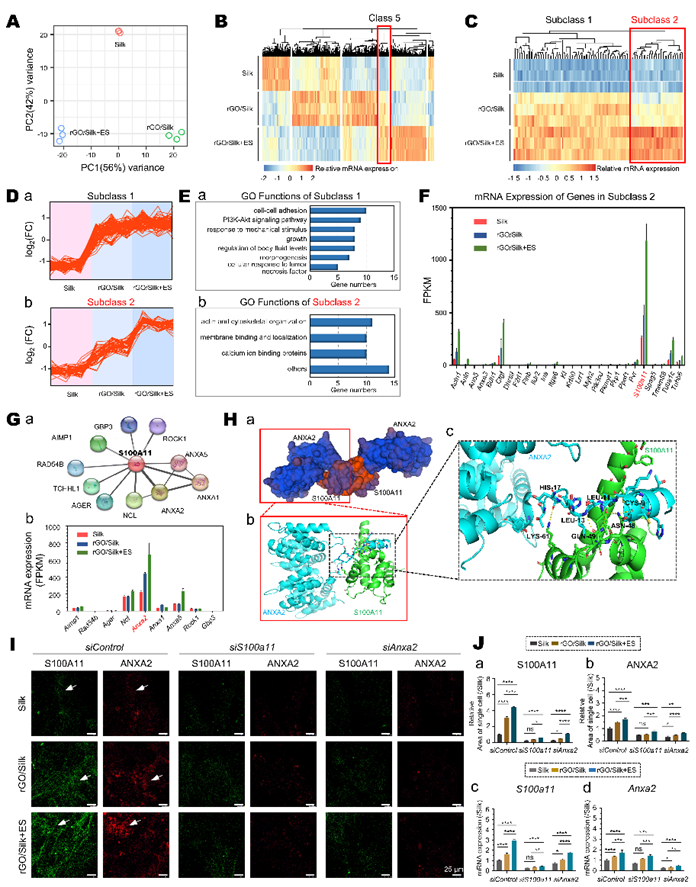
图2. S100A11/ANXA2复合体响应外源电信号调控
(图源:Xue et al., Biomaterials, 2025)
通过基因功能沉默实验,研究探讨了S100A11/ANXA2复合体是否介导ECT的电转导并调控E−C耦联,分析了骨架蛋白(β-Tubulin)、收缩蛋白(α-actinin、Cx43)、肌节结构、IMP、CICR及细胞内游离Ca²⁺水平。结果显示,rGO/Silk及rGO/Silk+ES显著上调了α-actinin、Cx43和β-Tubulin的表达,优化了肌节排列与细胞骨架结构;这可能提高收缩蛋白对Ca²⁺的敏感性与肌节收缩力。单独沉默S100a11或Anxa2会引起上述蛋白表达下降、肌节结构被破坏,这种结构丧失在同步沉默的细胞中更加显著。电生理功能显示,IMP与钙水平分析表明单独沉默S100a11或Anxa2均显著降低IMP与CICR的幅值与频率,同步沉默则导致IMP与CICR信号几乎完全消失,游离Ca²⁺水平进一步降低;同步缺失S100a11和Anxa2的细胞几乎完全丧失Ca²⁺瞬变与自发收缩能力,且该损伤无法被电刺激所逆转。单独沉默S100a11比Anxa2的作用更加显著。结构建模显示,S100A11/ANXA2复合体稳定结合Ca²⁺。这些结果提示,S100A11/ANXA2复合体是ECT响应电学微环境并参与调控心肌搏动功能的核心分子,通过协调Ca²⁺内流、CICR与细胞骨架重构,显著增强E−C耦联及整体心肌功能;并且S100A11可能在复合体中起主导作用(图3–4)。
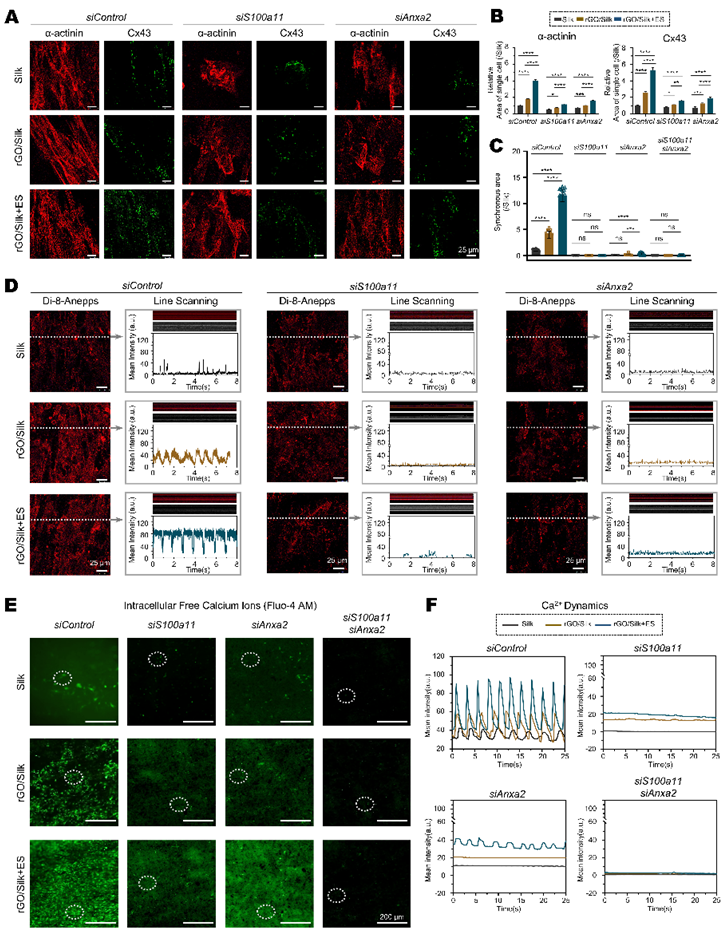
图3. S100A11/ANXA2将细胞外电学微环境信号转化为电控Ca²⁺内流,
并促进新生大鼠心肌细胞(NRCMs)的兴奋–收缩耦联
(图源:Xue et al., Biomaterials, 2025)
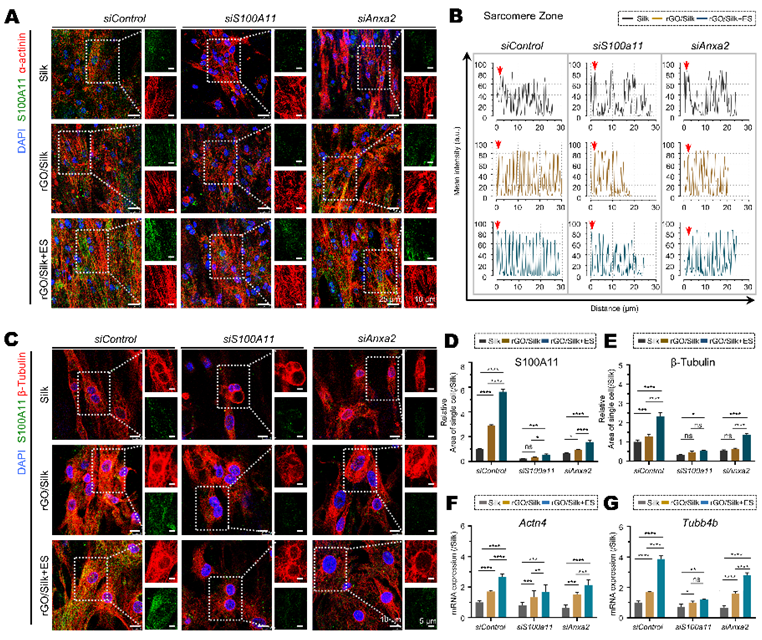
图4. S100A11/ANXA2将外源电信号转导为肌节结构重排和细胞骨架蛋白表达,
从而调控细胞的收缩功能
(图源:Xue et al., Biomaterials, 2025)
值得注意的是,研究团队还发现S100A11的表达并不局限于细胞质,其在细胞核中的表达受到电学微环境的调控。通过三维共聚焦显微分析发现,在Silk中,细胞核内S100A11表达极低;而在rGO/Silk组,尤其是rGO/Silk+ES组中,S100A11核内表达明显增强。敲低S100a11或Anxa2基因均显著抑制了S100A11的核转位,表明该过程依赖于S100A11/ANXA2复合体的形成。ANXA2本身定位于细胞质且不入核,提示其可能在S100A11穿越核膜过程中起辅助作用。进一步研究表明,在rGO/Silk和rGO/Silk+ES条件下,Gata4和Zfpm1的mRNA水平显著上调;而沉默S100a11或Anxa2则下调其表达,且电刺激只可部分恢复。这些结果提示,电信号诱导使得S100A11在ANXA2协助下核转位,从而上调Gata4和Zfpm1转录,可能会进一步促进心肌结构与功能相关基因的表达(图5)。
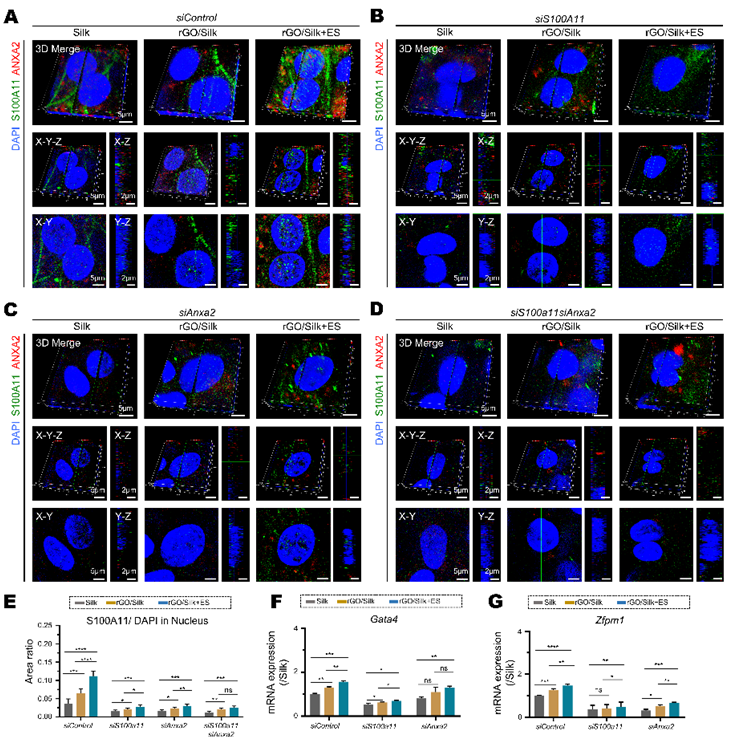
图5. S100A11外源在电信号诱导下被转运入细胞核,
并以ANXA2依赖的方式调控Zfpm1和Gata4的表达
(图源:Xue et al., Biomaterials, 2025)
综上所述,本研究综合运用材料学、组织工程学、分子生物学与生物信息学等多学科手段,首次揭示了S100A11/ANXA2介导的信号通路将外源电信号向细胞功能转化过程中的核心作用(图6)。该复合体不仅是电信号与钙信号、细胞骨架之间的关键桥梁,还可通过S100A11的核转位参与基因调控,进而实现从“电”到“结构”再到“功能”的多层级转化。外源电学信号既是触发因子,也是结构与功能重塑的驱动力,而S100A11/ANXA2复合体则是实现这一转化的核心执行者。该机制不仅揭示了电学微环境对心肌细胞的作用路径,也表明电学微环境与分子信号网络之间存在复杂的双向耦合关系,填补了心肌组织工程领域中电学微环境调控ECT功能成熟的分子机制方面的空白,为心脏修复和再生医学提供了新的思路,S100A11/ANXA2复合体介导的信号通路有望成为促进ECT功能成熟、增强移植组织与宿主心肌电学耦合和同步收缩、药物研发与基因治疗的新靶点。该电学与分子转导耦合的模式,有望扩展至神经、肌肉和骨组织工程等领域,具有广泛的跨学科应用前景。
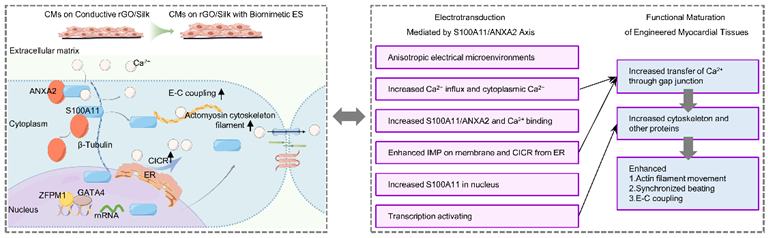
图6. S100A11/ANXA2通路示意图,
该通路将细胞外电信号转导为生化信号,并调控细胞的兴奋−收缩耦联功能
(图源:Xue et al., Biomaterials, 2025)
西安交通大学生命学院及生物医学信息工程教育部重点实验室为该论文的第一作者单位和通讯作者单位,文章第一作者为西安交通大学生命学院博士生薛莉,通讯作者为西安交通大学生命学院张晓慧教授、基础医学院肖正涛教授。本研究得到了国家重点研发计划、国家自然科学基金等项目的资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S0142961225006313
张晓慧,betway必威官方网站教授,国家级青年人才,长期致力于柔性传感与健康监测、功能生物材料与组织修复等相关领域研究。迄今已在Adv Funct Mater, ACS Nano, Chem Eng J, Biomaterials, Mater Horiz等国际知名学术期刊发表SCI论文70余篇。
